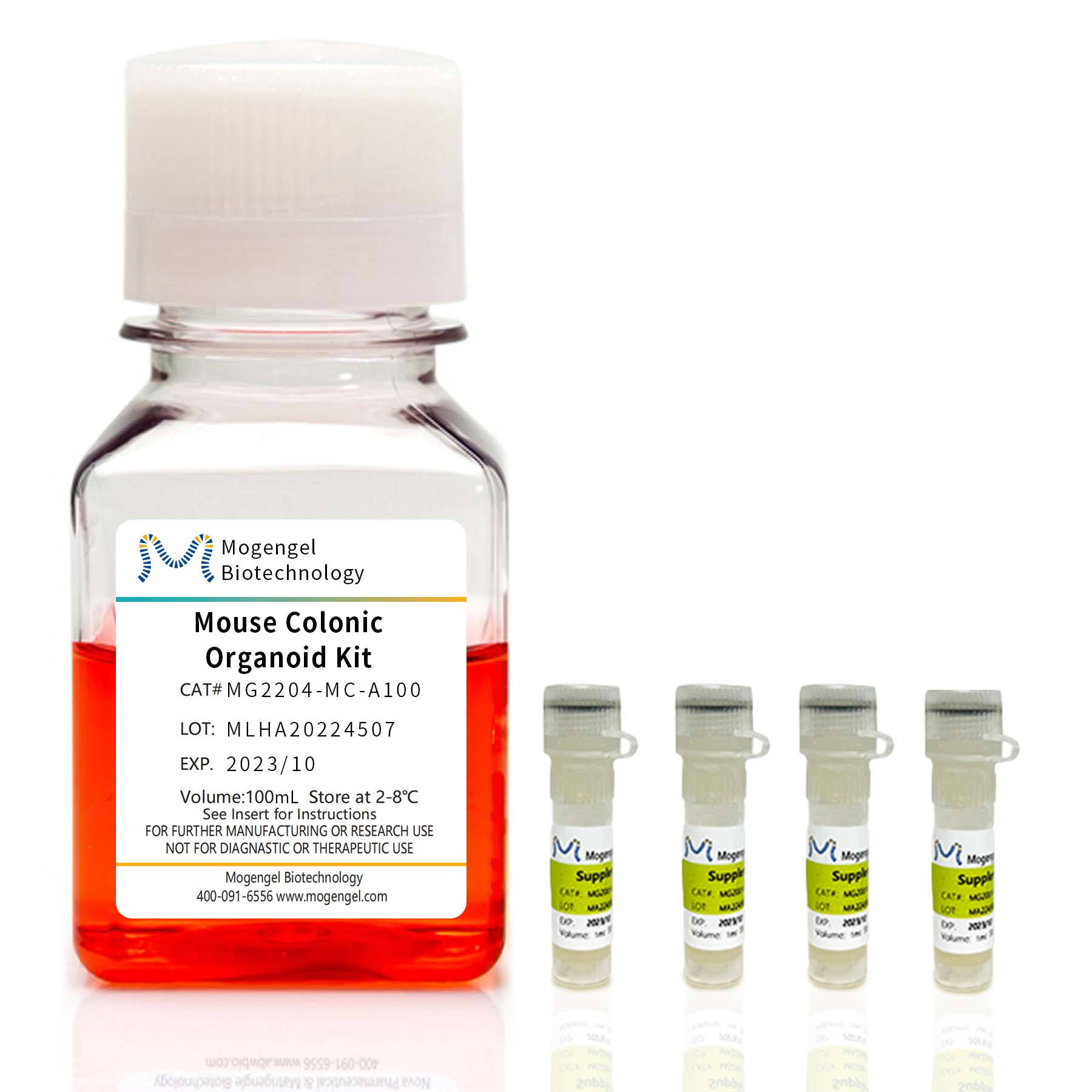
模基生物小鼠結腸類器官培養基套裝
產品描述
廈門模基生物小鼠結腸類器官培養基套裝是一款用于擴增和分化小鼠結腸類器官的完全培養基。擴增時的小鼠結腸類器官主要由結腸干細胞和結腸祖細胞組成,分化后的小鼠結腸類器官由結腸吸收細胞、杯狀細胞和少量腸內分泌細胞組成。結腸類器官在自我更新和分化能力、組織結構、細胞類型和功能方面,重現了體內結腸上皮的特征,因此是小鼠結腸研究的理想體外模型。
|
Organoid Kit |
Art.No. |
Components |
Specification |
Art.No. |
|
小鼠結腸 |
MA-0817H007L |
小鼠結腸類器官基礎培養基 |
500mL |
MG2204-MC-A500 |
|
小鼠結腸類器官培養因子B (50x) |
10mL |
MG2204-MC-B500 |
||
|
小鼠結腸類器官培養因子C (250x) |
2mL |
MG2204-MC-C500 |
||
|
小鼠結腸類器官培養因子D (250x) |
2mL |
MG2204-MC-D500 |
||
|
EDTA (0.5 M, pH 8.0) |
2mL |
E21912 |
||
|
MA-0817H007S |
小鼠結腸類器官基礎培養基 |
100mL |
MG2204-MC-A100 |
|
|
小鼠結腸類器官培養因子B (50x) |
2mL |
MG2204-MC-B100 |
||
|
小鼠結腸類器官培養因子C (250x) |
0.4mL |
MG2204-MC-C100 |
||
|
小鼠結腸類器官培養因子D (250x) |
0.4mL |
MG2204-MC-D100 |
||
|
EDTA (0.5 M, pH 8.0) |
1mL |
E21911 |
產品信息
其他自備材料和試劑
MG&ABW基質膠
上皮類器官基礎培養基
類器官消化液
潤洗液
類器官冷凍保存培養基(無血清)
DPBS (1X),液體,不含鈣和鎂
小鼠結腸類器官完全培養基的制備
使用無菌操作技術配制小鼠結腸類器官的擴增或分化培養基。以配制 10 mL 為例配置小鼠結腸類器官擴增或分化培養基,
如所需量不同,可相應調整用量。
1. 冰上解凍 Mouse Colonic Organoid Supplement B (50x),Mouse Colonic Organoid Supplement C (250x)和 Mouse
Colonic Organoid Supplement D (250x)。
2. 注意:各 Supplement 添加物解凍后,建議分別分裝后保存取用,避免反復凍融。
3. 小鼠結腸類器官的擴增培養基:將 200 uL Mouse Colonic Organoid Supplement B (50x),40 μL Mouse Colonic
Organoid Supplement C (250x) 和 40 μL Mouse Colonic Organoid Supplement D (250x) 加 至 9.72 mL Mouse
Colonic Organoid Basal Medium 中,充分混合,配制成 10 mL 小鼠結腸類器官擴增培養基。
4. 小鼠結腸類器官的分化培養基:將 200 μL Mouse Colonic Organoid Supplement B (50x),40 μL Mouse Colonic
Organoid Supplement C (250x) 加至 9.76 mL Mouse Colonic Organoid Basal Medium 中,充分混合,配制成 10 mL
小鼠結腸類器官分化培養基。
5. 注意:配制后的小鼠結腸類器官擴增或分化培養基可在 2 - 8°C 儲存 10 天。此外,Mouse Colonic Organoid
Supplement B(50x)內含有細菌及真菌抗生素(50x)。
小鼠結腸類器官原代培養
6. 依據所在單位批準的實驗動物倫理及操作規范進行動物組織取材,取材后的組織須在 2 - 8℃組織保存液或
DPBS 中迅速轉運至潔凈實驗室進行組織處理和干細胞分離。
7. 準備若干培養皿,加入 4℃預冷的 DPBS 備用。
8. 標準手術操作分離小鼠結腸組織,根據實驗需求取總長度 3 - 10 cm 的結腸段,置于含 DPBS 的培養皿中。
9. 于生物安全柜中使用移液管將結腸一端注入 DPBS 以沖洗腸內容物,沖洗后置于新的含 DPBS 的培養皿中,反
復沖洗數次至內容物完全被沖洗干凈,置于新的含 DPBS 的培養皿中。
10. 使用手術剪將腸管剪開,腸腔面朝上,一只手持手術鑷夾住腸組織一端,另一只手持手術刀片輕輕刮去腸腔表
面腸絨毛,待腸絨毛被刮凈后,將腸組織置于新的含 DPBS 的培養皿中清洗,重復清洗一次。
11. 將清洗后的結腸組織剪碎至約 2 mm 長寬,并轉移至 5 - 10 mL 含有 2 mM EDTA 的預冷 DPBS 中消化,4℃孵
育 30 min。
12. 消化完成后,將組織碎片轉移到新的含 DPBS 的培養皿中清洗,重復一次以去除 EDTA。
13. 用 5 mL 移液管在含冷的 DPBS 的培養皿或 50 mL 離心管中吹打、重懸組織碎片,使組織反復穿過移液管尖以
產生機械剪切力從而使隱窩與基底層分離,取一部分懸液鏡檢,當可以看到大量的隱窩樣結構后,停止吹打并將吹打后的組織懸液通過 70 μm 濾器過濾。
14. 收集濾液,300×g,4℃離心 3 min。
15. 棄上清,使用 1 mL DPBS 重懸組織沉淀,取 20 μL 懸液進行鏡檢和隱窩計數,計數完成后吸取包含所需隱窩量
的懸液,300×g,4℃離心 3 min,棄上清后置于冰上預冷。
16. 用適量的基質膠重懸組織沉淀,推薦重懸密度為每 25 μL基質膠懸液包含 50 - 300 個隱窩,重懸后置于冰上,重懸時間不超過 30 s 以避免基質膠過早凝固。
注意:Matrigel 稀釋比例應在 70%以上以保證培養過程中基質膠的結構穩定性。
17. 將基質膠和組織細胞小心均勻混合以防止氣泡產生并將懸液加入 24 孔板,25 μL 每孔滴加在孔底中心,避免懸液接觸孔板側壁。
注意:為防止基質膠室溫凝固,此步驟應盡快完成。
18. 將接種完成后的培養板置于 37℃二氧化碳恒溫培養箱中,孵育 15 min 左右待基質膠凝固后取出。
19. 提前配制小鼠結腸類器官擴增培養基。
20. 每孔沿孔壁加入 500 μL 提前預熱的小鼠結腸類器官擴增培養基,再向 24 孔板最外周孔中每孔加入 500 μL 無菌水,置于 37℃溫箱、5% CO2條件下培養。
注意:請沿孔壁緩慢加入,避免破壞已凝固結構。
21. 每 3 d 更換一次培養基,更換培養基時應避免破壞基質膠。
22. 密切監測類器官生長狀態,原代小鼠結腸類器官應在 5 - 7 d 內建成。
小鼠結腸類器官傳代培養和分化
1. 用經過潤洗液潤洗的槍頭吹打刮取類器官,并將類器官和培養基的懸液轉移至經過潤洗液潤洗的 1.5 mL EP 管中。
2. 用經過潤洗液潤洗的槍頭用力重懸類器官懸浮液,多次吹打使得類器官與基質膠分離。
3. 300×g,4℃離心 3 min,棄上清,用經過潤洗液潤洗的槍頭加入 200 μL類器官消化液并充分混勻,37℃條件下消化 1 - 3 min,消化結束后加入 1 mL上皮類器官基礎培養基吹打混勻。
4. 300×g,4℃離心 3 min,棄上清,再次加入 1 mL上皮類器官基礎培養基并混勻。
5. 300×g,4℃再次離心 3min,棄上清后置于冰上。
6. 用適量的基質膠重懸類器官沉淀,重懸后置于冰上,重懸時間不超過 30 s 以避免基質膠過早凝固。
注意:Matrigel 稀釋比例應在 70%以上以保證培養過程中基質膠的結構穩定性。
7. 將基質膠和類器官的混合懸液點入 24 孔板底部正中央,避免懸液接觸孔板側壁,每孔 30 μL 左右。
注意:為防止基質膠室溫凝固,此步驟應盡快完成。
8. 將接種完成后的培養板至于 37℃二氧化碳恒溫培養箱中,孵育 15 min 左右待基質膠凝固后取出。
9. 配制小鼠結腸類器官擴增培養基。
10. 待基質膠完全凝固后,沿孔壁加入提前預熱的小鼠結腸類器官擴增培養基,24 孔板每孔 500 μL。
11. 將 24 孔板置于 37℃二氧化碳培養箱中培養,待新長出的類器官直徑超過 100 μm 后可進行分化實驗。
12. 分化前需要吸去 24 孔板培養孔中的小鼠結腸類器官擴增培養基,并加入 500 μL 提前配制的分化培養基,分化
通常需要 4 d 以上時間,分化期間每隔 2 d 更換一次分化培養基,分化完成后可進行后續實驗。