腸道類器官應用思路

在前幾期中我們?yōu)榇蠹医榻B了小腸的結構、功能并為大家分享了腸道隱窩的分離與類器官培養(yǎng)方法。那么培養(yǎng)好的類器官都用來干嘛呢?本期將為大家提供一些腸道類器官的應用思路。
目前,類器官主要用于:
基于類器官的研究已經(jīng)為闡明腸道干細胞龕復雜的調(diào)控功能做出了突出的貢獻,尤其是通過類器官實驗,人們發(fā)現(xiàn)了R-spondins的受體Lgr4和Lgr5(de Lau et al. 2011)。
類器官可用來模擬疾病,主要通過引入與疾病相關的突變來模擬功能。通過從患者身上提取細胞進行類器官培養(yǎng)來闡明其發(fā)病機制。近年來,腸道類器官作為囊性纖維化和結直腸癌的診斷工具受到越來越多的關注(Dekkers et al., 2016a ; van de Wetering et al., 2015 )。患者來源的腸道類器官可以重現(xiàn)上皮功能和基因特征,結直腸癌患者來源的類器官可展現(xiàn)原發(fā)腫瘤的多種生物學特征。
鑒于腸道類器官移植的可行性已被證實,腸道類器官可能成為一種治療手段( Yui et al., 2012),這為再生醫(yī)學和整合基因編輯技術的基因治療開辟了新的可能性(Dekkers et al., 2016b)。目前腸道類器官技術依然處于快速發(fā)展階段,基于培養(yǎng)流程的普及和培養(yǎng)成本的降低,類器官技術在研究中的應用愈加廣泛,并將逐漸開始應用于新的領域。
此外,類器官以一種個體化的方式預測藥物療效,類器官技術結合高通量藥物篩選,將加速檢測基因-藥物之間的關聯(lián)性 (van de Wetering et al., 2015)。
最近幾年,涉及轉運體和受體的生理過程受到越來越多的關注,人們發(fā)現(xiàn)轉運體在腸道中發(fā)揮著雙向功能(Zietek and Daniel,2015)。除了具有在吸收性腸上皮細胞中的轉運功能,轉運體還在分泌激素的內(nèi)分泌細胞的頂端膜扮演著感受器的作用(Gorboulev et al.,2012),調(diào)控腸促胰島素釋放進入血液(Diakogiannaki et al.,2013;Roder et al.,2014)。既往研究中,腸道受體也被證明具有類似的調(diào)節(jié)腸道激素分泌的功能( Reimann et al.,2012 )。腸促胰島素GLP-1和GIP具有促進胰島素分泌的功能,對調(diào)節(jié)血糖水平至關重要。在腸內(nèi)分泌細胞中,轉運體和受體作為傳感器,成為2型糖尿病療法開發(fā)中具有高度潛力的靶點(Gribble and Reimann,2016;Zictek andDaniel,2015)。
在腸上皮細胞的營養(yǎng)、藥物的吸收功能和內(nèi)分泌細胞的激素分泌功能等方面(Petersen et al. ,2014;Schweinlinet al.,2016;Zietek et al., 2015 )。這些過程與營養(yǎng)吸收障礙疾病、藥物檢測和代謝紊亂疾病(如肥胖或2型糖尿病)高度相關,由于腸道類器官可以呈現(xiàn)體內(nèi)組織結構的重要特點,因此它成為高度分化的、功能健全的腸上皮細胞的良好來源。
除此之外,通過利用特定的調(diào)節(jié)因子如γ-分泌酶抑制劑,類器官還可富集腸道稀有細胞類型,如腸內(nèi)分泌細胞,其在正常生理條件下僅占腸上皮細胞的1%(Petersen et al.,2015)。以此為基礎的類器官培養(yǎng)將極大地促進實驗技術的發(fā)展,對科學研究具有深遠的影響。

用于腸道營養(yǎng)研究的類器官模型
研究證實,腸道類器官包含腸上皮的所有細胞類型(Sato et al.,2009;Spence et al., 2011),包括分泌GIP和GLP-1的腸內(nèi)分泌細胞( Petersen et al.,2014;Petersen et al. 2015)。類器官可來自小鼠或人的腸道組織,用標準的細胞培養(yǎng)皿培養(yǎng),并可在實驗室通過傳代培養(yǎng)數(shù)月,因此,最近研究者在探究小鼠腸道類器官是否可以成為用于腸道轉運、感知和激素分泌研究的體外模型(Zietek et al.,2015),由于腸道營養(yǎng)轉運體特異性表達于膜的頂部或基底外側,因此類器官的上皮包含極化的腸上皮細胞。研究發(fā)現(xiàn),許多營養(yǎng)轉運體,如SGLT1、PEPT1或GLUT5,均表達于面向腸腔的頂端膜,以從消化的食物中吸收營養(yǎng)(Daniel and Zietek,2015)。然而,其他一些營養(yǎng)轉運體,如氨基酸轉運體或GLUT2,則表達于基底膜,從而介導來自腸上皮細胞的養(yǎng)分進入血液循環(huán)(Roder et al. 2014),因此,保證目的轉運蛋白定位在腸道類器官的正確位置是非常重要的。
在研究特定激素分泌時,確保類器官培養(yǎng)中包含腸內(nèi)分泌細胞亦非常必要,最簡便的方法便是將類器官包埋于石蠟中,進行免疫熒光檢測。在研究轉運蛋白(或其它腸道蛋白)時,推薦利用缺乏目的蛋白表達的敲除小鼠進行類器官培養(yǎng)來驗證染色的特異性。根據(jù)不同的目的蛋白,在構建類器官時選擇正確的部位較為關鍵,腸道部位與腸道激素分泌的研究也同樣相關,不同亞型的腸內(nèi)分泌細胞分布在腸道的不同部位。值得注意的是,從近端小腸到遠端小腸,分離所得到的隱窩明顯減少,培養(yǎng)所得到的類器官也明顯減少。在研究營養(yǎng)感知時,如果所研究的傳感器蛋白的表達位置與目標腸內(nèi)分泌細胞亞型的分布位置不同則需要做出折中。
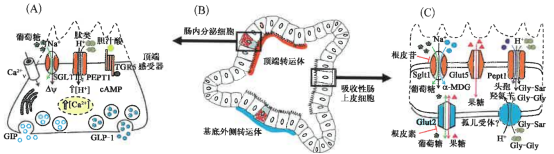
類器官用于腸道轉運、感知、激素分泌示意圖
宿主-微生物相互作用是指微生物(如細菌、寄生蟲、病毒)與宿主(如人類、動物)之間發(fā)生的相互作用,宿主-微生物相互作用的研究需要合適的模型系統(tǒng)來模擬體內(nèi)感染。在過去的幾十年里,研究者們采用了各種體內(nèi)外實驗模型來研究宿主與微生物的相互作用,這些模型的最終目的是在體外創(chuàng)建一個能夠模擬人體真實情況的環(huán)境,以闡明健康和疾病中宿主反應的生理機制。這些模型包括來源于人或動物細胞的細胞培養(yǎng)系(Dingli and Nowak,2006),可經(jīng)口或接種感染病原體的選定動物模型(Fang et al.,2013),以及模擬宿主-細菌相互作用的類器官(Fatehullah et al.,2016)。對于某些感染因子而言,目前完全缺乏良好的模型系統(tǒng),而對于另一些感染因子,現(xiàn)有的模型也并非最佳。
非類器官方法及類器官方法在宿主-細菌相互作用研究中的優(yōu)缺點如下。
腸道上皮是成年哺乳動物中自我更新速度最快的組織,它包括一系列分化的細胞類型,每個類型都有其自身的特性。大多數(shù)用于研究沙門菌和腸道上皮細胞之間相互作用的體外模型無法重現(xiàn)在正常腸道中觀察到的分化組織成分和結構。創(chuàng)建分化細胞的一種方法是通過懸浮培養(yǎng)技術,該技術使用旋轉壁式生物反應器使細胞保持懸浮并無氣泡通氣,以這種方式形成的三維(3D)聚合體的特征在于具有細胞極性、細胞外基質(zhì)產(chǎn)生和器官特異性分化。然而,該系統(tǒng)可能缺乏負責腸道組織更新的正常干細胞生態(tài)位(Zhang et al.,2014)。
新近發(fā)展起來的類器官模型充當了體內(nèi)外系統(tǒng)之間的橋梁,Ootani等報道了一種復雜的培養(yǎng)體系,即在基質(zhì)細胞的支持下,將整個腸組織切片包埋在3D膠原結構中(Ootani et al.,2009)。Sato及其同事建立了一個相對簡單的類器官培養(yǎng)系統(tǒng),使用基質(zhì)膠作為ECM替代品,并輔以構成關鍵內(nèi)源性生態(tài)位信號的生長因子。該系統(tǒng)已被用于創(chuàng)建具有明顯隱窩和絨毛樣結構域的三維結構,該結構與中央管腔相鄰,其中包含從不斷更新的上皮層中擠出的死細胞(Sato et al.,2009)。類器官如實再現(xiàn)了體內(nèi)上皮結構,并包含完整的干細胞、祖細胞和分化細胞類型(Fatehullah et al.,2016;Sato et al.,2009)。此后,腸道類器官被用于基礎和臨床研究的各個方面,包括用于產(chǎn)生人腸道類器官,以及用于從具有不同遺傳修飾的動物模型中產(chǎn)生類器官。

利用來源于隱窩的小鼠腸道類器官,研究者能夠直觀觀察鼠傷寒沙門菌的侵襲性以及類器官的形態(tài)變化(Zhang et al.,2014)。在類器官中,結構域與中央管腔相鄰,中央管腔含有從不斷更新的上皮層擠出的死細胞,研究者利用致病性傷寒沙門菌14028S(10°CFU)定植感染培養(yǎng)物。第一個30min的孵育使細菌接觸到類器官細胞表面,30min后,用Hank's平衡鹽溶液(Hank's balanced salt solution,HBSS)洗去細胞外細菌。之后,將受感染的類器官在含有慶大霉素的培養(yǎng)基中培養(yǎng)1h。研究人員發(fā)現(xiàn)細菌感染顯著抑制了類器官的生長,包括出芽和類器官培養(yǎng)物的總面積。鼠傷寒沙門菌進入類器官的上皮細胞,導致緊密連接的破壞。例如,在沙門菌感染的類器官中,緊密連接(tight junction,TJ)蛋白ZO-1染色減少并斷開連接(圖13.1)。有趣的是,TJ蛋白Claudin7似乎沒有受到影響。
在感染沙門菌的類器官中檢測了基于NF-kB通路激活的炎癥反應。沙門菌感染的類器官中總kBα顯著減少,磷酸化IkBα增加,磷酸化NF-kB p65也有所增加。通過共聚焦顯微鏡觀察,研究人員發(fā)現(xiàn)NF-kB p65已轉移到感染沙門菌的類器官的細胞核中。作為NF-kB激活的下游靶點,與沒有任何感染的類器官相比,受感染類器官中的炎性細胞因子(例如,IL-2、IL-4、IL-6和TNF-a)顯著增加,而且,ELISA對沙門菌感染后1h培養(yǎng)液中IL-6蛋白的檢測靈敏度足夠高。感染1、2、4h后,培養(yǎng)基中的ⅡL-6 蛋白顯著增強(Zhang et al.,2014)。此外,western blot、PCR和免疫熒光數(shù)據(jù)表明,沙門菌感染(使用GFP標志的Lgr5類器官)顯著降低了干細胞標志物(Lgr5和Bmil)。
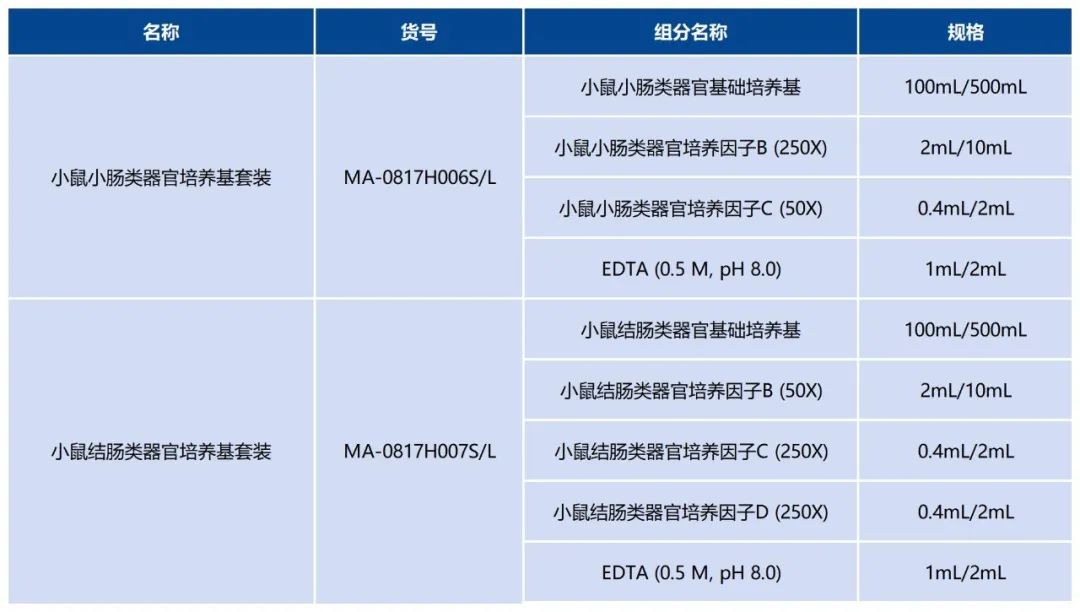
小鼠腸道類器官培養(yǎng)基套裝推薦
因此,研究者首次建立了一個體外模型系統(tǒng),再現(xiàn)了沙門菌感染腸道的體內(nèi)研究中的一些觀察結果,包括沙門菌入侵、緊密連接結構破壞、炎癥細胞因子增加以及宿主-細菌相互作用期間干細胞標志物減少等。該研究證明,沙門菌感染的類器官培養(yǎng)系統(tǒng)是研究宿主-細菌相互作用的一種全新的、可行的實驗工具。
Forbester等利用來源于人誘導多能干細胞(human induced pluripotent stem cells, hiPSCs)的腸道類器官(intestinal organoids,iHOs)(Forbester et al.,2014;Forbester et al. 2015),建立了類器官腔內(nèi)微量注射鼠傷寒沙門菌的方法。RNA測序顯示,與對照組相比,感染了鼠傷寒沙門菌的腸道類器官中1448個基因顯著上調(diào)、577個基因顯著下調(diào);上調(diào)的基因包括編碼促炎細胞因子的基因,如CCL20、IL1B和IL23A等。利用缺失SPI-1 Ⅲ型分泌系統(tǒng)中invA組分的鼠傷寒沙門菌突變株,F(xiàn)orbeste等證明該系統(tǒng)可用于功能性評估特定突變體的發(fā)病機制(Forbester et al.,2014;Forbester et al.,2015)。
顯微注射含細菌的類器官可以在相對可控的環(huán)境中模擬細菌感染,在沒有免疫細胞或共生菌引入混雜變量的情況下,可以直接檢測病原體與上皮細胞的相互作用。Wilson等報道,野生型小鼠和Mmp7小鼠類器官中的Paneth細胞產(chǎn)生含有α-防御素的顆粒。
類器官形成一個密閉的管腔,其中含有一定濃度的α-防御素,能夠在感染后至少20h內(nèi)限制鼠傷寒沙門菌的生長( Wilson et al.,2015)。
除了致病性細菌研究外,類器官還可用于共生菌、益生菌以及微生物組學研究。例如,離子組成和pH的區(qū)域特異性變化與管腔和黏膜相關細菌的區(qū)域特異性改變相關,一般來說,厚壁菌門(Firmicutes)普遍減少,而擬桿菌門(Bacteroidetdes)成員增加(如多形擬桿菌)(Engevik et al.,2013)。在野生型和NHE3末端回腸類器官中接種多形擬桿菌均顯示fut2和巖藻糖基化增加。這些數(shù)據(jù)表明,單獨的多形擬桿菌足以在體內(nèi)觀察到增加的巖藻糖基化(Engevik et al.,2013)。
文章1:Recapitulating macro-scale tissue self-organization through organoid bioprinting
文章簡介:開發(fā)了一種生物打印輔助的組織形成方法,通過3D生物打印引導控制幾何形狀和細胞密度形成具有自組織特征的納米級組織,可形成類似腸胃交界處的組織。
文章2:Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration
文章簡介:提出了一種構建研究腸上皮損傷后再生的類器官模型,并揭示了兩種表觀遺傳調(diào)節(jié)因子在調(diào)控腸道損傷后再生過程中的關鍵作用和機制的方法。
作為“萬病之源”,所有已知的人類疾病中高達90%都可追溯道不健康的腸道。因此,腸類器官并不局限于腸道疾病研究。
文章1:Co-emergence of cardiac and gut tissues promotes cardiomyocyte maturation within human iPSC-derived organoids
文章簡介:證明了類器官中內(nèi)胚層組織(腸)的存在有助于心臟管形成后階段特征的心臟組織特征的發(fā)展,包括心肌細胞擴張、區(qū)室化、心房/淋巴結細胞富集、心肌壓實和胎兒樣功能成熟。總體而言,這項研究證明了在單個類器官模型中產(chǎn)生和成熟來自不同種譜系的合作組織的能力,這一進展將進一步檢查發(fā)育,生理成熟和疾病過程中的多組織相互作用。
文章2:The Intestinal Microbiota Modulates the Anticancer Immune Effects of Cyclophosphamide
文章簡介:環(huán)磷酰胺改變了小腸中微生物群的組成,并誘導選定的革蘭氏陽性細菌物種易位到次級淋巴器官。以此表明腸道微生物有助于抗癌作用。
文章3:A gut-secreted peptide suppresses arousability from sleep
文章簡介:高等腸道中的蛋白質(zhì)濃度導致腸內(nèi)分泌細胞活性增加釋放肽CCHa1,CCHa1向一小群多巴胺神經(jīng)元發(fā)出信號在大腦中調(diào)節(jié)其活動;多巴胺能活性調(diào)節(jié)行為動物對振動的反應。
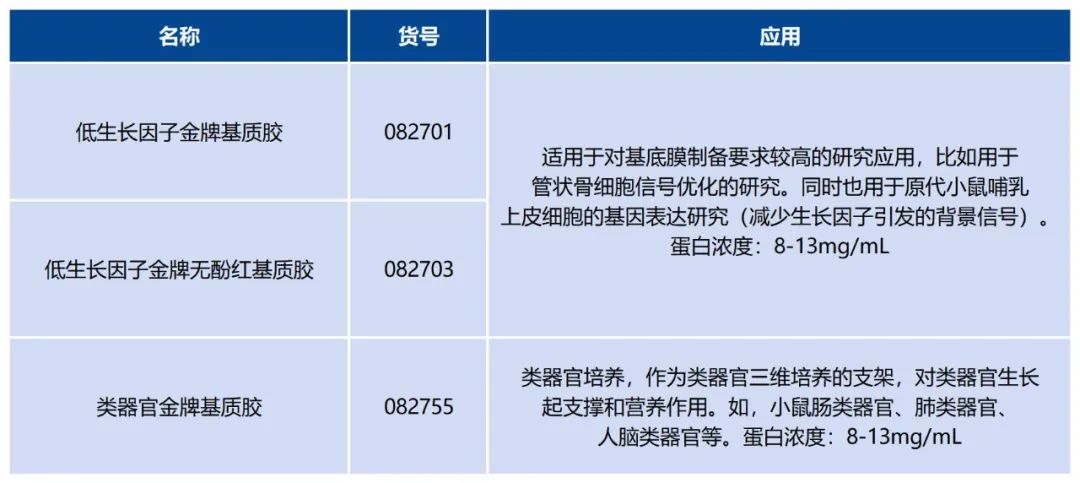
類器官專用基質(zhì)膠推薦
廈門模基生物科技有限公司(Xiamen Mogengel)位于中國·廈門國家高新技術創(chuàng)業(yè)中心。公司致力于3D細胞培養(yǎng)核心原材料的研發(fā)與產(chǎn)業(yè)化升級。目前公司的產(chǎn)品有基質(zhì)膠、類器官培養(yǎng)基、細胞因子、3D細胞培養(yǎng)耗材、3D細胞培養(yǎng)智能顯微鏡等。公司擁有4大技術研發(fā)中心:分子克隆和細胞編輯中心、實驗動物中心、蛋白表達和純化平臺、類器官質(zhì)檢系統(tǒng)和自動化。
團隊擁有十余年類器官技術研究基礎,實力雄厚,科研意志堅定,學術態(tài)度嚴謹,大膽嘗試,勇于創(chuàng)新。公司推出的基質(zhì)膠、類器官培養(yǎng)試劑盒等產(chǎn)品廣泛適用于類器官培養(yǎng)、血管生成實驗、細胞侵襲(transwell)實驗、PDX、CDX模型實驗、腫瘤球培養(yǎng)、腫瘤移植、皮下成瘤實驗、干細胞培養(yǎng)及細胞分化研究以及其他待開發(fā)實驗類型。